In この記事のパート 1, 私は、BioNTech/ファイザー契約を使用して、プロセスを説明するために、Covid mRNAショットの初期開発、製造、取得に米国政府によって適用される契約および規制の枠組みをレビューしました。
これらの製品には、臨床試験と製造プロセスに基づいて緊急使用許可(EUA)が付与されていることを示しました。
- 拘束力のある法的基準はなく、
- 法的に禁止されている安全監視や規制がないこと、および
- 潜在的な危害に対するメーカーからの法的救済はありません。
このフォローアップ記事では、基礎となるドキュメントの詳細な分析を提供します。
その他の取引権限/協定 (OTA): 軍事調達経路
契約 2020年19月に国防総省(DoD)を代表とする米国政府と、BioNTech/ファイザー提携を代表するファイザーとの間で締結された「新型コロナウイルス感染症を予防するワクチン」の購入は、通常の買収契約ではなかった。
これは、Other Transaction Authority (OTA) に基づく合意であり、買収経路によれば、 国防総省のガイドライン、1958 年以来、「連邦政府機関が 契約、助成金、協同組合協定以外の取引に設立された地域オフィスに加えて、さらにローカルカスタマーサポートを提供できるようになります。」
[太字を追加]
法定の歴史を含む国防総省による OTA の使用に関する徹底的なレビューは、次のリンクで見つけることができます。 22 年 2019 月 XNUMX 日議会調査局レポート。このレポートは、OTA に関する他のすべての議論と同様に、OTA が代替の取得パスであることを明記しています。 防衛および軍事目的のため。これは、主に民間使用を目的としたものではなく、新型コロナウイルス感染症以前には使用されたこともありません。
あなたが探しているなら 米国法典における OTA 法、これがあなたが進む道です:
軍隊 -> 一般軍法 -> 調達 -> 研究およびエンジニアリング -> 協定 -> 特定のプロトタイププロジェクトを実行する国防総省の権限
この法的経路は、OTA 法が軍隊のための研究および工学プロトタイプの取得を目的としていることを非常に明確に示しています。
国防総省は、(1) 研究 OT、(2) プロトタイプ OT、および (3) 実稼働 OT の XNUMX つの異なるタイプの OT に対する権限を持っています。
これら 3 種類の OT は、初期研究、プロトタイプの開発、最終的な生産の 3 つの段階を表します。
これら 3 つのタイプの中に、OTA が適用できるプロジェクトの特定のカテゴリがあります。
- もともと、それによると、 OTAの概要 国防総省によって規定されたその他の取引当局は、「国防総省によって取得または開発されることが提案されている兵器または兵器システムに適用されることに限定されている」。
- OTA は後に拡張され、「軍関係者の任務効率の向上と、国防総省によって取得または開発が提案されたサポート プラットフォーム、システム、コンポーネント、または材料、またはプラットフォーム、システム、コンポーネントの改善に直接関連するあらゆるプロトタイプ プロジェクト」が含まれるようになりました。 、または軍隊によって使用されている物質。」
今のところ、主に民間使用を目的とした何百万もの新規医療製品の入手経路のようには見えません。
新型コロナウイルスmRNAワクチンに適用される可能性のあるOTAの民間使用に関する例外はありますか?
2004 年度国防権限法 (P.L. 108-136) この文書には、「テロ、核、生物、生物兵器に対する防衛または復興を促進する可能性のある基礎研究、応用研究、高度な研究および開発プロジェクトに従事する執行機関の長」にその他の取引権限を付与する条項が含まれていた。化学攻撃または放射線攻撃。」
この規定は 2018 年まで延長されましたが、その年以降は延長されないようです。また、国防総省以外による OTA の使用という例外的なケースであっても、 状況にはテロまたは大量破壊兵器(CBRN)による攻撃が含まれている必要があります.
他にどのような OTA 法が適用される可能性がありますか?
上で引用した 2019 年の CRS レポートには次の図が示されており、国防総省以外のいくつかの機関が OTA または関連当局を持っていることが示されています。
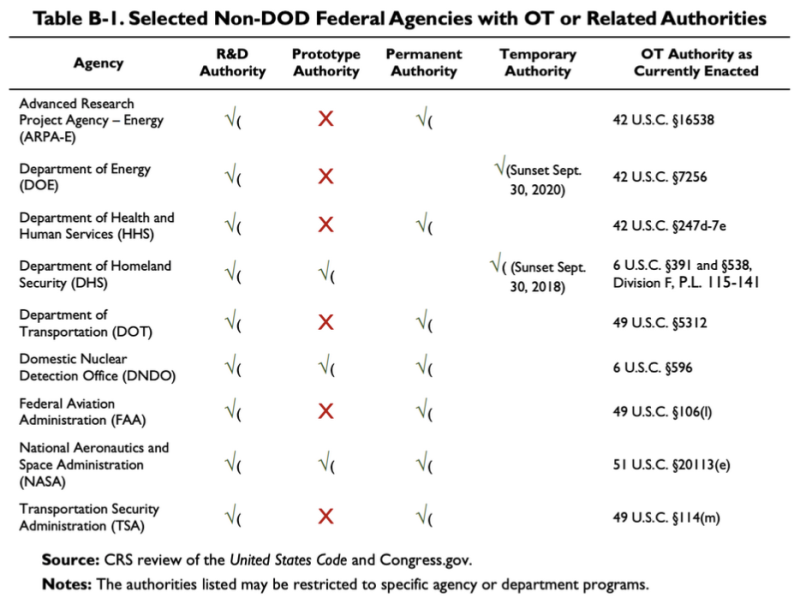
この表によると、保健福祉省 (HHS) にはいくつかの研究開発 (R&D) のその他の取引権限があります。に関連する法律 HHS の OT 権限は 42 U.S.C. です。 §247d-7e.
この法律はどこに記載されており、どのような内容が記載されていますか?
公衆衛生と福祉 -> 公衆衛生サービス -> 一般権限と義務 -> 連邦国家協力 -> 生物医学先端研究開発局 (BARDA) -> 取引当局
したがって、民間の健康と福祉に関連する法律には、有効であるにもかかわらず、OTA が適用される可能性がある箇所があります。 研究開発のみを目的としており、試作や製造は対象外です。
法律では、BARDA 秘書が OT 権限を有すると定められています。
現在またはそうなる可能性のある製品に関しては、 適切な対策 または 認定されたパンデミックまたは流行製品、主に—
(i) 製品の基礎研究および前臨床開発の後に実施される。そして
(ii) 商業規模での製品の製造に関連しており、 連邦政府の規制要件を満たす形式で 食品、医薬品、化粧品法 [21 USC 301 以降] 以下 このタイトルのセクション 262.
[太字を追加]
法律に列挙されている「規制要件」は、厳格な安全性試験と厳格な製造監督を受けていない医療製品(mRNAワクチンなど)について、たとえ研究開発であっても、BARDA/HHSが契約を結ぶことは不可能であることを意味している。
保健省と国防総省の「パートナーシップ」が文民保護法を回避
文民当局全般、特に新型コロナウイルス mRNA ワクチンに関するその他の取引当局/協定の苦境を要約すると、次のようになります。
- OTA は、軍隊が多くの官僚的な事務手続きを行わずに武器やその他の必要なシステムや装備を入手する方法として書かれ、成文化されました。研究開発、試作、その後の製造までをカバーします。
- 公衆衛生機関向けの唯一の OTA は HHS 向けであり、研究開発のみが対象であり、プロトタイプや製造は対象外です。
- HHS に与えられた研究開発 OTA でさえ、依然として医薬品とワクチンの安全性のために「規制要件を満たす形式で」製品を製造することを求めています。
言い換えれば、HHS がその非常に限られた OTA を利用して数億の新規医療製品の契約を結ぶことはあり得ないということです。
それでHHSは何をしたのですか?
政府会計検査院 (GAO) が次のように述べています。 「新型コロナウイルス感染症の契約」に関する 2021 年 19 月のレポート: HHS は国防総省と「提携」し、「国防総省の OTA 権限を活用しました…HHS にはそれがありませんでした」。 (p。24)
国防総省の医療製品に関する OT 当局とは何ですか?
すでに説明したように、OTA は軍が官僚的な煩わしさを伴うことなく装備やテクノロジーを入手できるようにすることを目的としています。 OTA に関連する当初の法律には、「軍人の任務効率を高める」ことを目的とした「プラットフォーム、システム、コンポーネント、または材料」以外のことについては言及されていませんでした。
しかし、Covid の 5 年前に、OTA の例外的な使用法が導入されました。
2015年には、 国防総省が発表 CBRN医療対策コンソーシアムの設立。その目的は、OTA取得経路を利用して「国防総省と協力して、FDA認可の化学的、生物学的、放射線学的、核医学的対策を開発する」ことであった。 [FDA = 食品医薬品局]
2015年の発表に記載されているように、これには「国防総省が関心を寄せるウイルス、細菌、生物毒素の標的を標的とした治療的医療対策のプロトタイプ技術」が含まれていた。病原体のリストには、炭疽菌、エボラ菌、マールブルグ菌などの生物兵器の主要な病原体が含まれていました。
この発表ではさらに、「実現技術には、ウイルス、細菌、または生物学的毒素による疾患および病因(複数の曝露経路)の動物モデル、アッセイ、診断技術、または承認または認可されたMCMの開発に適用できるその他のプラットフォーム技術が含まれる可能性がある」と明記されています。 【医学的対策】。」
これはまだ民間用に 100 億個の新規ワクチンを生産するようなものではありませんが、HHS に与えられた非常に限られたその他の取引権限よりも OTA に大きな自由を与えます。
HHS OTA では広範な開発および製造規制の順守が必要ですが、国防総省が医療対策を開発するための OTA 経路には「FDA ライセンス」のみが必要です。
したがって、国防総省のその他の取引当局を使用すると、OTA 生成製品の FDA ライセンスの要件に応じて、理論的にはあらゆる安全規制を回避することが可能になります。これから見るように、Covid mRNAワクチンの場合は緊急使用許可が与えられ、法的な安全性の監視はまったく必要ありませんでした。
緊急使用許可(EUA)
食品医薬品局のやり方はこうだ (FDA) EUA の権限について説明:
FD&C 法第 564 条 (21 USC 360bbb–3)により、FDA は生物剤、化学剤、核剤、放射性物質に対する公衆衛生保護を強化することができます。
この EUA 権限により、FDA は、生物学的、化学的、核的、または放射性物質によって引き起こされる重篤または生命を脅かす疾患や状態を診断、治療、または予防するために、適切で承認された適切な医薬品がない場合に、緊急時に医療対策を確実に使用できるように支援することができます。 、および利用可能な代替案(他の基準とともに)。
これらの EUA の権限は、CBRN (化学、生物、放射線、核) 兵器として知られる大量破壊兵器による攻撃への備えに関連する非常に特殊な状況下で 2004 年に付与されたものであることを理解することが非常に重要です。
説明したように ハーバード大学法の健康法案に記載されている,
結局のところ、緊急使用許可を生み出すのは対テロ戦争だった。 11 年 2001 月 XNUMX 日の事件とその後の炭疽菌郵便攻撃の後、議会は 2004 年プロジェクト バイオシールド法。同法は、バイオテロ攻撃に備えたワクチンの購入や緊急対策の備蓄に数十億ドルの支出を求めている。緊急時に迅速に行動できるようにするため、議会はFDAに対し、公衆衛生と安全への脅威に対する緊急使用として正式に未承認の製品を認可することを許可した(HHSによる緊急事態宣言が条件となる)。の 記録 これは、議会が自然発生的なパンデミックへの備えではなく、特にバイオテロの脅威に焦点を当てていたことを示している。
EUA法の文言 これは、それが大量破壊兵器を伴う状況での使用を目的としていたという事実を強調しています。 EUA が発行できる 4 つの状況は次のとおりです。
- 生物剤、化学剤、放射線剤、または核剤による攻撃の危険性が高まる国内緊急事態が存在する、または国内緊急事態の重大な可能性があるとの国土安全保障長官の判断。
- 軍事的緊急事態が存在する、または軍事的緊急事態の重大な可能性があり、ユナイテッドに対するリスクの増大を伴うと国防長官が判断したこと。 米国 タイトル 10 またはタイトル 50 の権限の下で活動する人員を含む軍隊は、次のものによる攻撃を行う。
- 生物学的、化学的、放射性物質、または核物質、または複数の物質。または
- ユナイテッド航空に差し迫った生命を脅かす特定のリスクを引き起こす可能性がある、または関連する単数または複数の薬剤 米国 軍事力;
- による決定 秘書 国家安全保障またはユナイテッド航空の健康と安全に影響を与える、または影響を与える重大な可能性がある公衆衛生上の緊急事態、または公衆衛生上の緊急事態が発生する重大な可能性があること 米国 海外に居住しており、生物学的、化学的、放射性物質、または核物質、またはそのような物質に起因する可能性のある病気や状態に関係する国民。または
- のセクション 319F–2 に基づく重大な脅威の特定 公衆衛生局法 [42 USC 247d–6b] 国家安全保障またはユナイテッド航空の健康と安全に影響を与えるのに十分な 米国 海外に住む国民。
これら 4 つの状況のどこにも、「生物剤、化学剤、放射性物質、または核物質」によって引き起こされない、自然に発生する伝染病、パンデミック、またはその他の種類の公衆衛生状況については言及されていません。
SARS-CoV-2 はそのような病原体に該当するでしょうか?
「」の定義を調べてみると、生物剤」米国法典では、次の経路をたどることになります。
犯罪と刑事訴訟 -> 犯罪 -> 生物兵器 -> 定義
したがって、米国法の文脈では、「生物剤」という用語は生物兵器を意味し、そのような生物剤/武器の使用は犯罪とみなされます。
ウィキペディアにはこれが記載されています 定義:
生物剤 (生物剤、生物脅威剤、生物兵器、生物兵器、生物兵器とも呼ばれる) は、 細菌, ウイルス, 原虫, 寄生虫, 菌、または武器として意図的に使用できる毒素。 バイオテロ or 生物戦争 (白黒)。
新型コロナウイルス mRNA ワクチンに対して EUA はどのような法的根拠に基づいて発行されましたか?
EUA に関する法律に基づくと、この法律に記載されている 4 つの考えられる状況はいずれも、自然に発生する病原体によって引き起こされる病気の予防または治療を目的とした製品には適用できないように思えます。
それにもかかわらず、この法律はmRNA Covidワクチンを認可するために使用されました。
EUA法にリストされている4つの選択肢を考慮すると、Covidの「対策」に使用されたのは次のとおりです。
C) による決定 秘書 国家安全保障またはユナイテッド航空の健康と安全に影響を与える、または影響を与える重大な可能性がある公衆衛生上の緊急事態、または公衆衛生上の緊急事態が発生する重大な可能性があること 米国 海外に居住する国民であり、生物学的、化学的、放射性物質、または核物質、またはそのような物質に起因する可能性のある病気や症状が関与するもの。
日時 Covidに特に適用される、このように表現されました。
保健福祉省(HHS)長官は、国家安全保障、または海外に住む米国国民の健康と安全に重大な影響を与える可能性があり、コロナウイルスを引き起こすウイルスが関係する公衆衛生上の緊急事態が発生していると判断した。 2019 年の病気 (新型コロナウイルス感染症)…
ここで、「新型コロナウイルス感染症を引き起こすウイルス」が「生物学的、化学的、放射性物質、または核物質」と同等であるとみなされることに疑いの余地はありません。
EUAの「公衆衛生上の緊急事態の決定」は、WHOや米国政府によってなされたもののような他の公衆衛生上の緊急事態宣言とは完全に別のものであり、いかなる形でも依存していないことに注意することも重要です。 、そしてCovid-19パンデミックの初めの大統領。
したがって、WHO、米国政府、大統領がパンデミックが終息したと宣言したとしても、HHS長官がセクションC)に記載されている状況が存在すると主張し続ければ、依然として緊急使用許可が得られる可能性がある。
を見て 数百もの新型コロナウイルス関連医療製品のすべての EUA、すべてではないにしても、ほとんどの場合、保健省長官が「国家安全保障、または海外に住む米国国民の健康と安全に重大な影響を与える可能性のある公衆衛生上の緊急事態が発生している」という主張をどのように正当化できるのかを理解することは非常に困難です。これらのケースの。
FDAが緊急使用許可を与えるための追加の「法的基準」
法律に記載されている 4 つの状況のいずれかに基づいて、HHS 長官が EUA を正当化する公衆衛生上の緊急事態があると宣言すると、FDA が EUA を発行するにはさらに 4 つの「法定基準」を満たす必要があります。 。 FDA はこれらの要件を次のように説明しています:
- 重篤または生命を脅かす病気または状態
FDA が EUA を発行するには、HHS 長官の EUA 宣言で言及されている CBRN 薬剤が、重篤または生命を脅かす病気や症状を引き起こす可能性がある必要があります。
注: この基準は、犯罪を実行するために使用される武器として法的に定義されている CBRN エージェントの仕様を繰り返しています。
- 有効性の証拠
EUA の対象として検討される可能性のある医療製品は、HHS 長官の宣言で特定された CBRN 病原体によって引き起こされる可能性のある重篤または生命を脅かす疾患や症状の予防、診断、または治療に「効果がある可能性がある」製品です。第 564 条 (b) に基づく緊急事態または緊急事態の脅威。
EUA の「有効である可能性がある」基準は、FDA が製品承認に使用する「有効性」基準よりも低いレベルの証拠を提供します。 FDA は、以下で説明するように、リスク利益分析を使用して、可能性のある EUA 製品の潜在的な有効性をケースバイケースで評価する予定です。
[太字を追加]
法的質問: EUA の法的基準が「有効である可能性がある」ものであり、FDA が使用されている基準よりも「証拠レベルが低い」と宣言している場合、EUA に基づいて認可された製品が「安全で有効」であると法的に主張するにはどうすればよいでしょうか。定期的な製品承認のために?
- リスクと利益の分析
特定の疾患または症状の診断、予防、または治療に使用した場合の製品の既知および潜在的な利点が、製品の既知および潜在的なリスクを上回ると長官が判断した場合、製品は EUA の対象とみなされる可能性があります。
製品の既知および潜在的な利点が既知および潜在的なリスクを上回るかどうかを判断する際に、FDA は 見るつもりです 総合的なリスクと利益の判断を行うための科学的証拠を総合的に判断します。そのような証拠は、 起こるかもしれない さまざまな情報源から、 含めることができます (ただしこれらに限定されません):国内外の臨床試験結果、動物モデルによるin vivo有効性データ、in vitroデータ、 FDA の検討に利用可能。 FDA はまた、 入手可能な証拠、現在の科学的知識を考慮すると。
[太字を追加]
法的注意: 「既知および潜在的な利益」が「既知および潜在的なリスク」を上回ることを意味する法的基準や法的定義はありません。また、リスク便益分析の「基礎となる」許容可能な「利用可能な証拠」を構成する定性的または定量的な法的定義もありません。実際の証拠がゼロであっても、製品には多くの潜在的な利点があるが、潜在的なリスクはそれほど多くないという信念があれば、この「法的要件」は満たされます。
- 代替手段なし
FDA が EUA を発行するには、疾患または状態の診断、予防、または治療のための候補製品に代わる適切で承認済みの利用可能な代替品が存在していなければなりません。緊急ニーズを完全に満たすために承認された代替品の供給が不十分な場合、潜在的な代替製品は「利用できない」とみなされる場合があります。
法的質問: イベルメクチンやヒドロキシクロロキンのような、Covid-19 の代替治療法のひどい、犯罪の可能性がある中傷/非合法化とは別に、「Covid-19 の予防」(mRNA ワクチンが購入された唯一の目的) のための承認された代替療法はどの時点にありましたか? ) – たとえば、Paxlovid – mRNA ワクチンの EUA が合法でなくなるのはどの国でしょうか?
これらすべての「法定基準」が実際の環境でどのように満たされたかを次に示します。 BioNTEch/Pfizer Covid mRNAワクチンの緊急使用許可:
私は、認可の範囲 (セクション II) に記載されているとおりに投与された場合の、新型コロナウイルス感染症予防のためのファイザー-BioNTech COVID‑19 ワクチンの緊急使用は、米国特許第 19 条(c) に基づく認可発行の基準を満たしていると結論付けました。この法律の理由は次のとおりです。
- SARS-CoV-2 は、このウイルスに感染した人間に重篤な呼吸器疾患を含む重篤または生命を脅かす病気や状態を引き起こす可能性があります。
- FDA が入手可能な科学的証拠の全体に基づいて、ファイザーとバイオNTech の新型コロナウイルス感染症ワクチンは、 新型コロナウイルス感染症の予防に効果がある可能性がある、およびこの承認に記載されている条件下で使用した場合、ファイザー・バイオNTech 新型コロナウイルス感染症ワクチンの既知および潜在的な利点が得られること 新型コロナウイルス感染症(COVID-19)を予防するために使用される場合 既知のリスクと潜在的なリスクを上回る。そして
- ファイザー-BioNTech 新型コロナウイルス感染症ワクチンの緊急使用に代わる、適切で承認された利用可能な代替手段はありません。 新型コロナウイルス感染症(COVID-19)を防ぐために.
[太字を追加]
注: FDA がワクチンの潜在的な利点とリスクを比較検討し、FDA がワクチンが「有効である可能性がある」と判断した唯一の状況は、 新型コロナウイルス感染症(Covid-19)の予防において.
実際の利益または潜在的な利益についての検討や証拠はなく、重篤な病気のリスクの低下、入院のリスクの低下、死亡のリスクの低下など、ワクチンがその他の効果をもたらす潜在的な有効性があるかどうかについての決定もありません。 、Covid-19に実際に関連する、または潜在的に関連するあらゆる症状のリスクを低下させます。
したがって、「新型コロナウイルス感染症を予防する目的で使用される場合」以外の文脈で、ワクチンが「安全で効果的」であるという主張の合法性には当然の疑問が生じるかもしれませんが、ワクチンが使用されて間もなくはそのようなことは行わないことが知られていました。紹介された。
もし人々が、BioNTech/ファイザーのmRNAワクチンは新型コロナウイルス感染症の予防以外には「安全で効果的」だと言われ、また、新型コロナウイルス感染症の予防以外の目的でワクチンを摂取しなかった場合に何らかの結果が生じると脅されたら、人々は行動するだろうか。不正な請求に基づいて未承認製品の摂取を不法に強制されたという正当な主張があるだろうか?
未承認製品に対する EUA の第 3 層要件
EUA固有の緊急事態宣言が出され、FDAがその製品が有効である可能性があり、入手可能な証拠が何であれ(ゼロから無限まで)その利点がリスクを上回ることを示したと宣言した場合(FDAがどのように考えているかによって決定されます) be)、安全性や有効性以外に関連する規制がもう 1 つあります。
方法は次のとおりです。 EUAに関する2018年議会調査局報告書 これを説明します:
FFDCA §564 は、EUA に特定の必須条件を課すよう FDA に指示し、必要に応じて追加の裁量条件を許可します。必要な条件は、EUA が未承認製品に対するものであるか、承認済み製品の未承認使用に対するものであるかによって異なります。未承認の製品の使用条件は次のとおりです。
(1) 製品を投与する医療専門家が必要な情報を確実に受け取れるようにする。
(2) 製品が投与される個人が必要な情報を確実に受け取れるようにする。
(3) 製品に関連する有害事象の監視と報告を提供する。そして
(4) 製造業者による記録保持と報告を提供する。
法的な質問: 「必要な情報」とは正確には何ですか?ワクチンに緊急使用許可が与えられたことが人々に知らされたことは承知しています。しかし、これは他の医療製品の「安全で効果的な」主張に必要な「証拠レベルが低い」ことを意味すると彼らは言われたのでしょうか?製品が EUA または別の種類の認可を受けているかどうかに応じて、「安全で効果的」のレベルが異なることを彼らは知らされましたか?
注: 法律では、有害事象を監視し報告する方法を確立することが求められています。しかし、誰が監視するのか、報告の基準は何か、報告に基づいて行動を起こすための基準は何なのかについては述べられていない。
EUA と他のすべての医薬品/ワクチン承認経路との比較
研究者・作家として サーシャ・ラティポワ EUA は「Expanded Access Use」の略である EAU によく似ているため、多くの人が EUA と混同していると指摘しました。これは、アクセスと引き換えに有害事象や、場合によっては死亡の危険を冒すことをいとわない特定の患者グループ(例、余命が月単位で測定されるステージIVのがん患者)によって緊急の必要性がある場合に、医療製品に与えられる認可の一種です。実験的な治療へ。
緊急使用許可は、拡張アクセス使用とはまったく関係がなく、また類似性もありません。
医療製品を認可するためのさまざまな法的経路が、法律研究者によって強調表示された表にきちんと示されています。 キャサリン・ワット。この表は、FDA-CDC 共同学習セッションの 2020 年のプレゼンテーションの一部です。 医療対策の使用に関する規制の最新情報.
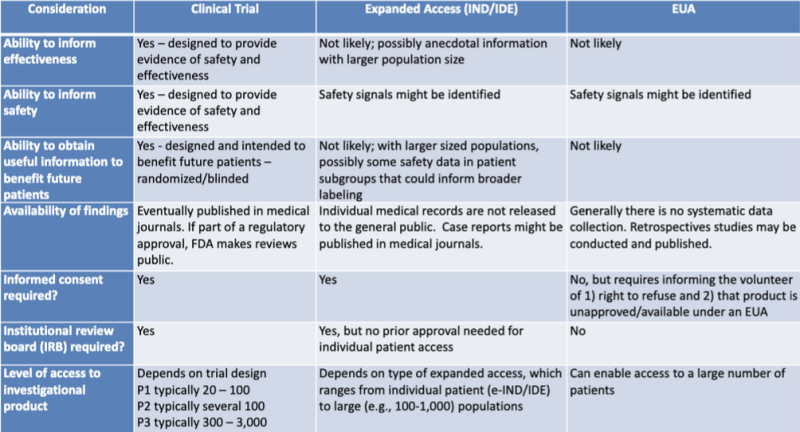
この表は、EUA プロセスが製品の有効性に関する情報を提供する可能性が低いこと、安全性の証拠を提供するように設計されていないこと、将来の患者に利益をもたらす有益な情報を提供する可能性が低いこと、体系的なデータ収集が含まれていないこと、遡及研究が必要ないこと、インフォームド・コンセントも治験審査委員会もありません。
また、 2009年国立医学研究所の学術出版物、これもワットが取り上げた「医療対策: 調剤緊急使用許可と郵便モデル – ワークショップの概要」というタイトルの論文で、この声明は 28 ページにあります。 XNUMX:
EUA は開発経路の一部ではないことを認識することが重要です。これは緊急事態時にのみ使用される完全に別個の組織であり、医薬品承認プロセスの一部ではありません。
これは、EUAに基づく新型コロナウイルス感染症対策の承認が違法だったということになるのでしょうか? EUA製品は医薬品承認プロセスの一部ではないため、EUA製品が「安全で効果的」であると主張する法的方法はないということですか?
まとめ
この記事と前の記事のすべての情報を考慮すると、それは明らかです。 第1部、BioNTach/Pfizer Covid mRNAワクチンは、民間人全体に影響を与える自然発生疾患ではなく、生物戦争/テロリズムを伴う緊急事態のために予約された軍法に基づいて開発、製造、認可されたものであると述べています。
したがって、製品が民間人全体にとって「安全で効果的」であるとみなされる場合に期待される規制の順守や監視は法的に要求されませんでした。
この分析は、EUA が何を意味するかを知っていた政府関係者による「安全で効果的な」主張の合法性に異議を唱えるために使用できるでしょうか?他に法的な影響はありますか?
そうだといい。
重要なのは、これまでに提起されたCovid mRNAワクチンに対する法的異議申し立てにおいて、OTAやEUAのような軍法を民間の状況に適用できるかどうかについての判決は(私が知っている限りでは)ないということです。しかし、地方裁判所のマイケル・トランケイル判事は、次のように述べている。 内部告発者の事件の却下 ブルック・ジャクソン対ベンタビアおよびファイザー、それを心に留めておくことが重要です。
ここで判事は、BioNTech/ファイザーのmRNAワクチンに関する合意が軍事用OTAであったことは認めているが、その合意が成立した非軍事的状況(自然発生疾患、100億回分の投与はほとんどが軍事用途ではない)への適用性についての裁定を拒否している。発行されました:
軍人と民間人の両方がワクチンを接種したという事実は、ワクチンの取得が軍の任務の有効性を高めることに無関係であることを示すものではありません。さらに重要なことは、ジャクソン女史が事実上、ファイザーのワクチンを購入するためにその他の取引権限を行使するという国防総省の決定を覆すよう当裁判所に求めていることだ。しかし、合衆国最高裁判所が長年強調してきたように、「軍隊の構成、訓練、装備、統制に関する複雑かつ微妙で専門的な決定は、本質的には専門的な軍事判断である」。 ギリガン対モーガン、413 米国 1、10 (1973年)。したがって、「裁判所の権限が劣る政府活動分野を考えるのは困難」である。同上。当法廷は、国家非常事態における任務の有効性に関する国防省の判決に拒否権を発動しない。
これは、新型コロナウイルス感染症の緊急事態下で承認されたすべての mRNA 製品、およびその後の新型コロナウイルス感染症の承認プロセスに基づいて承認されたすべての mRNA 製品を最終的に非合法化するという戦いにおいて残された多くの法的ハードルの 19 つにすぎません。
の下で公開 Creative Commons Attribution4.0国際ライセンス
再版の場合は正規リンクをオリジナルに戻してください。 褐色砂岩研究所 記事と著者。









