最近 調査結果 ファイザーとモデルナの新型コロナウイルス感染症ワクチンに含まれるDNA断片の検出により、ワクチンの品質と安全性の監視を担当するFDAがなぜ警鐘を鳴らさなかったのか疑問の声が多く上がっている。
FDAは何年も前から、ワクチン中の残留DNAによってもたらされるリスクについて知っていました。 独自の 業界への指導 状態:
「残留 DNA は発がん性や感染性の可能性があるため、最終製品にリスクをもたらす可能性があります。 コードされた癌遺伝子の組み込みと発現、または DNA 組み込み後の挿入突然変異誘発など、残留 DNA が発癌性となる可能性のあるメカニズムがいくつか考えられます。」
簡単に言うと、FDA は、製造プロセスで残った DNA の断片が患者自身の DNA に組み込まれ、がんを引き起こす可能性がある可能性を認めています。
FDA と WHO のガイドラインでは、従来のワクチンの 10 回投与中に残留する DNA の量は XNUMX ng (XNUMX 億分の XNUMX グラム) を超えてはいけないと考えられています。
しかし、従来のワクチンに用いられていたこの制限は、脂質ナノ粒子が細胞内に浸透してmRNAを効率的に送達できるmRNAワクチンには当てはまらない可能性が高い。
最近の プレプリント シュパイヒャーによる論文 ら カナダの一価および二価mRNAワクチンのバッチを分析しました。
著者らは、「これらのワクチンには、10回の投与につき数十億から数千億のDNA分子が存在する」ことを発見した。 蛍光分析を使用すると、すべてのワクチンは、FDA と WHO が設定した残留 DNA のガイドラインである XNUMX ng/回を超えています。」
スペイサー ら また、FDA ガイドラインを超える 200 塩基対 (DNA の長さの尺度) を超える DNA フラグメントが見つかったことも報告しました。
注目すべきことに、著者らはファイザー製品について、ワクチンに含まれるDNA断片のレベルが高くなるほど、重篤な有害事象の発生率が高くなる、とコメントしている。
一部の専門家は、ヒトにおけるゲノム統合のリスクは 非常に低い、しかし最近の での出版 自然 線状の DNA 片を含むトランスフェクション溶液と混合すると、約 7% の細胞が統合されることを発見しました。
FDAは懸念していますか?
米国食品医薬品局(FDA)は、新型コロナウイルスワクチンに残留するDNA汚染は問題ではなく、「mRNAワクチンの品質、安全性、有効性に関する調査結果を支持している」と主張し続けている。
「これまで理論的問題として懸念が提起されてきたが、入手可能な科学的証拠は、微量の残留DNAはがんを引き起こしたり、人の遺伝情報に変化を引き起こしたりしないという結論を裏付けている」とFDAは付け加えた。
FDAはその主張を裏付ける「利用可能な科学的証拠」を提供しなかったが、ワクチン自体の製品ラベルには遺伝毒性と発がん性試験が行われたことが示されていることは注目に値する。 使用前に実行されます。
デビッド・ワイズマン、医療製品開発に携わる研究生物科学者、シュパイヒャー研究の共著者 ら がんとの関連性を示す証拠はないというFDAの主張は「支持できなくなってきている」と述べた。
「VAERSにおけるワクチンの安全性シグナルに関するCDC独自の分析は、一部のがんに対するシグナルがある可能性を示している」とワイズマン氏は述べた。 レポート 彼は共著を執筆し、国立アカデミーに送った。
表 (黄色で強調表示) では、PRR とマークされた列の値が 2 を超え、カイ 4 乗列の値が XNUMX を超えた場合、安全性シグナルは重要であり、さらなる調査の価値があると考えられます。
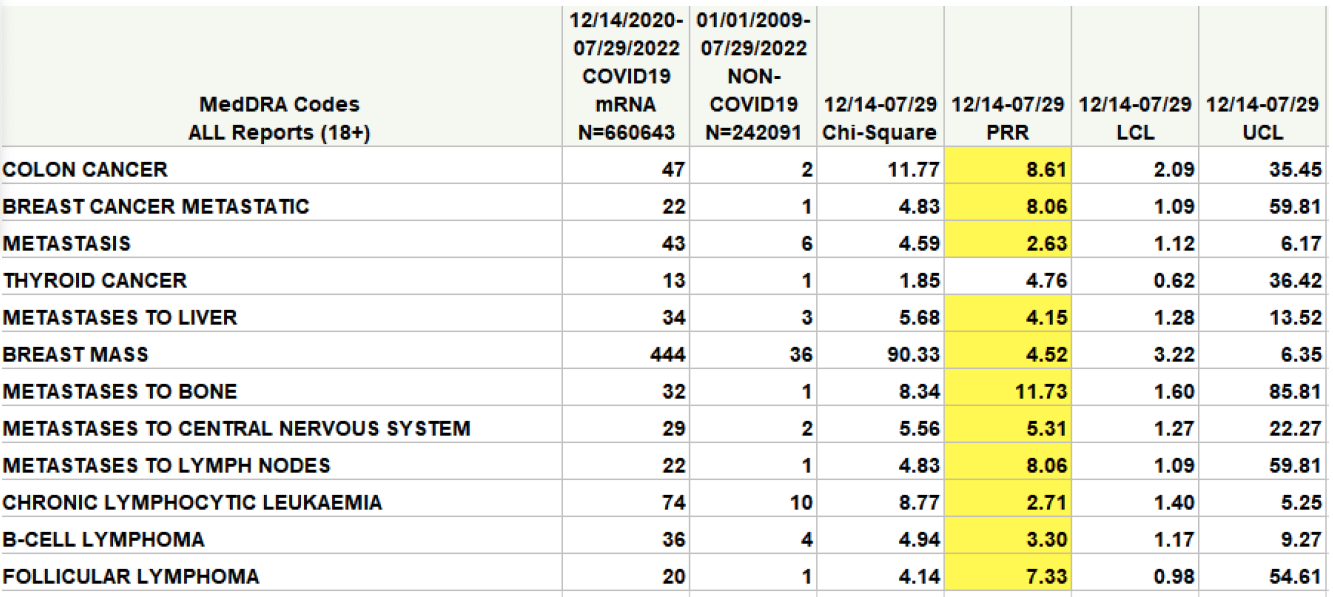
FDAは、許容レベルを超えるDNAレベルが検出されたかどうか、またさらなる調査を行っているかどうかについては確認していない。
その代わり、数カ月にわたる調査の後、FDAは私(および他のメディア)に「XNUMX億回以上のmRNAワクチンが投与されたが、残留DNAに関連する安全性の懸念は確認されていない」という定型的な回答を送ってきた。
試験と監督に関する一連の質問に対し、FDAは「現時点で提供できる追加情報はない」と述べた。
不十分な製造監督
現在、臨床試験 (プロセス 1) で使用されたファイザーのワクチンは、 別に製造された より広範囲の人々に接種されたワクチンに適用されます (プロセス 2)。
この スイッチ プロセス 1 からプロセス 2 までの過程で、プラスミド DNA 不純物 (赤丸を参照) が導入され、ワクチンの安全性プロファイルが変化する可能性があります。
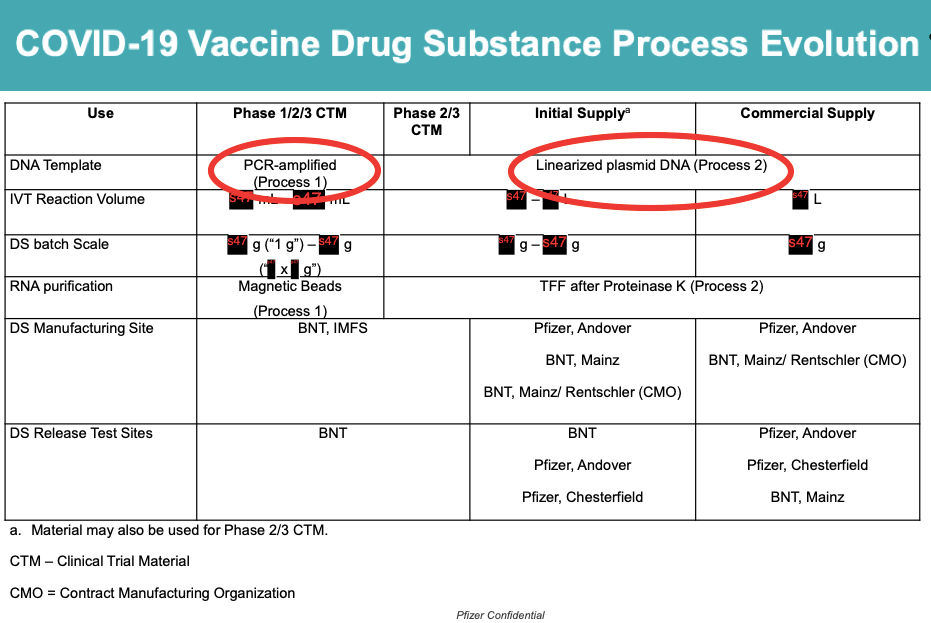
私は FDA に、XNUMX つのプロセスの比較に関する人間のデータがあるかどうか尋ねました。
当局は私に FDA の EUA を教えてくれました レビューメモ 20年2020月XNUMX日付で、検査が「進行中」であることを示唆していた。
XNUMX 年前の文書には、「複数の DP 製造ノードからの追加ロットを含む、より包括的な比較可能性評価は、 継続 そして結果は研究完了時にEUAに提供される。」
FDAに「進行中の」結果へのアクセスを求めたところ、ファイザーから情報を入手するよう指示されましたが、製薬会社は私の問い合わせに応じませんでした。
情報の自由 要求 ニック・ハント著 毎日の懐疑論者 その理由を説明できるかもしれない。
ファイザーは規制当局に対し、参加者における2021つのプロセスの安全性と免疫原性を比較し、XNUMX年XNUMX月までに報告することを約束したが、それらの研究は決して行われなかったようだ。
FOIは次のように述べた。
…2020年4591001月、C1研究に、2歳から16歳の参加者を対象に「プロセス55」または「プロセス20」を製造して製造されたワクチンの安全性と免疫原性を記述する探索的目的が追加されました。 この探索的目的は、「プロセス 2022」で製造されたワクチンの広範な使用のため、2 年 XNUMX 月に削除され、議定書修正第 XNUMX 号に文書化されました。 したがって、このプロセスの比較は、プロトコル修正の正式な文書の一部としては行われませんでした。[強調された]
ワイズマン氏は、「プロセスの変化の大きさを考えると、医薬品開発における私の経験から、この種の生物学的比較可能性研究は間違いなくファイザーによって実施されることが予想されていただろう」と述べた。
同氏はさらに、「ファイザーにフリーパスが与えられたという事実は、規制上の監督に重大な欠陥があったことを示している」と付け加えた。
今年初めにワクチンに含まれるDNA断片を発見したゲノミクス専門家のケビン・マッカーナン氏は、現在ファイザーがこの比較試験を実施する「インセンティブ」はない、と述べた。
「これは私の憶測ですが、彼らは見ていたのではないかと思います」 有害事象の増加 商用バッチを使用して、その時点で列車が駅を出発したことを知ってデータを埋めました」とマッカーナン氏は語った。
「ワクチン接種をやめるという政治的意志はなかったし、おそらくファイザーは規制当局が国民向けの市販バッチの検査を行わなくても許されることを知っていたのだろう」と同氏は付け加えた。
著者からの転載 サブスタック
の下で公開 Creative Commons Attribution4.0国際ライセンス
再版の場合は正規リンクをオリジナルに戻してください。 褐色砂岩研究所 記事と著者。









